La mole, abbreviata con il simbolo mol, è l'unità di misura della quantità di sostanza. Rappresenta, riferito a una qualsiasi sostanza o più precisamente entità, la quantità di atomi dell'isotopo 12 del carbonio (12C) presente in 12 grammi della stessa sostanza. La quantità di una singola mole è, inoltre, pari al numero di Avogadro che ha valore pari a 6.022 · 1023.
Il concetto di mole è adimensionale poiché è efficace per misurare la quantità di qualsiasi entità, ad esempio una mole di acqua sarà costituita sempre da 6.022 * 1023 molecole di acqua, esattamente come una mole di ossigeno molecolare sarà formata da 6.022 * 1023 atomi di ossigeno. Per questa ragione, il concetto di mole è spesso associato al concetto di particella, definendo - in termine generico - una "mole di particelle" o "una mole di legami chimici".
Il sistema internazionale, riconosce la mole come unità di misura standard ed è, per questa ragione, una delle sette unità di misura fondamentali. L'accettazione da parte del sistema internazione, permette che il concetto di mole non abbia alcun confine e, allo stesso tempo, sia universalmente accettato.
Calcolo della mole e relazione con il numero di Avogadro
È possibile risalire al numero di moli di una sostanza conoscendone alcune misure, ad esempio la massa molare. Il calcolo della quantità di particelle presente in una mole tiene conto del rapporto tra 12g di 12C contro la sua massa atomica assoluta, misurata sperimentalmente attraverso la spettrometria di massa.
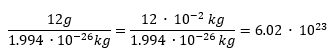
Calcolo della mole e del numero di Avogadro.
Relazione tra mole e massa molare
La massa molare o Mm è la quantità di sostanza, espressa in grammi, presente in una mole della sostanza stessa. L'unità di misura della massa molare è il grammo su mole, che si indica con g/mol oppure con g · mol-1.
Conversioni tra mole e altre unità di misura
Attraverso alcune semplice equazioni è possibile convertire valori espressi in moli, in altre unità di misura e viceversa.
Da massa in grammi a moli
La conversione da massa, espressa in grammi, a moli è un semplice rapporto:
n (mol) = m (g) / Mm (g · mol-1)
Da moli a massa
La conversione da moli (n) a massa, espressa in grammi, è l'inverso della conversione da massa a moli:
m (g) = n (mol) · Mm (g · mol-1)
Da moli a numero di particelle
La conversione da moli (n) a numero di particelle (N) tiene conto del numero di Avogadro (NA):
N = NA · n (mol)
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?