L'atomo rappresenta la più piccola unità organizzata della molecola, giacché è considerata la struttura che caratterizza, in parte oppure totalmente, la molecola della quale fa parte. Più atomi formano le molecole mentre esso stesso è costituito dalle particelle sub-atomiche che, a loro volta, potrebbero essere formate da entità ancora più piccole.
L'atomo rappresenta la parte più piccola della materia. La diversa presenza delle particelle subatomiche e degli elettroni caratterizza proprietà fisiche e chimiche relative all'atomo stesso e all'elemento relativo. In altre parole, le particelle subatomiche sono molto diverse tra loro ma possiedono le medesime caratteristiche. Protoni e neutroni formano il nucleo di tutti gli elementi, mentre gli elettroni, ruotando attorno al nucleo, completano l'atomo, bilanciandone la carica.
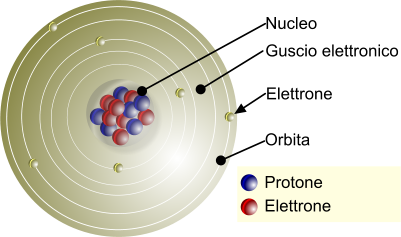
Struttura "classica" semplificata dell'atomo. Protoni e neutroni formano il
nucleo atomico. Gli elettroni sono disposti lungo il cosiddetto
guscio esterno. Secondo il modello atomico più accreditato, gli elettroni non si dispongono dentro delle orbite ma all'interno dell'
orbitale atomico.
L'unione di diverse particelle subatomiche, secondo schemi più o meno restrittivi, porta alla formazione di atomi diversi che prendono il nome di elementi. Un atomo di ossigeno, ad esempio, è formato dalle stesse particelle subatomiche presenti in un atomo di ferro in quantità, rispettivamente, diverse.
Teoria atomica
La teoria atomica rappresenta la costruzione teorica del "funzionamento" dell'atomo. Nel corso degli anni, diverse ipotesi sono state avanzate per spiegare il comportamento fisico e chimico dell'atomo e, attraverso la verifica sperimentale, è stato possibile validarle e, allo stesso tempo, miglorarle anche parzialmente. L'atomo, secondo la concezione attuale, è il frutto della ricerca e della sperimentazione operata da fisici e chimici a partire dal XIX secolo che, con i loro contributi, hanno permesso la creazione di un modello di atomo fisicamente accetabile.
L'atomo di Dalton
Il chimico John Dalton fu il primo a proporre una visione "scientifica" dell'atomo. Secondo le sue osservazioni, un atomo è la più piccola unità indivisibile della materia. Diversi atomi possono combinarsi tra di loro, a patto di rispettare alcune regole di proporzione e, di conseguenza, possono mantenere la massa eguale durante queste "ricombinazioni". L'elemento è il raggruppamento degli atomi simili per proprietà chimico-fisiche.
Il modello atomico di Thomson
Le osservazioni del fisico Joseph Thomson servirono per iniziare un approccio, nei confronti dell'atomo, più teorico. L'elaborazione delle caratteristiche fisiche e chimiche dell'atomo venivano proposte sotto forma di "modello". Il modello atomico di Thomson, in altre parole, era una teorizzazione su base scientifica, con verifica sperimentale, delle proprietà intrinseche all'atomo stesso. Secondo il modello atomico di Thomson, l'atomo era formato da un nucleo centrale denso, con carica positiva, e da una serie di elettroni immersi in esso, carichi negativamente e in egual numero rispetto alle cariche positive.
La carica netta dell'atomo era bilanciata e, di conseguenza, pari a zero.
Il modello atomico di Rutherford
Il fisico Ernest Rutherford, ebbe l'idea di utilizzare le radiazioni per determinare il "volume" del nucleo rispetto al guscio esterno, caricato negativamente. Scoprì, sfruttando una rudimentale radiografia, che solo una piccola parte delle radiazioni veniva deviata, intuendo che il nucleo occupasse un'altrettanto piccola parte del volume totale dell'atomo. Nel modello atomico di Rutherford, in altre parole, il nucleo carico positivamente aveva un volume più piccolo rispetto al guscio esterno, carico negativamente. Inoltre, intuì che il guscio esterno non era statico, ma formato da particelle corpuscolari, gli elettroni, che ruotavano attorno ad esseo. Definì questa condizione come moto planetario degli elettroni.
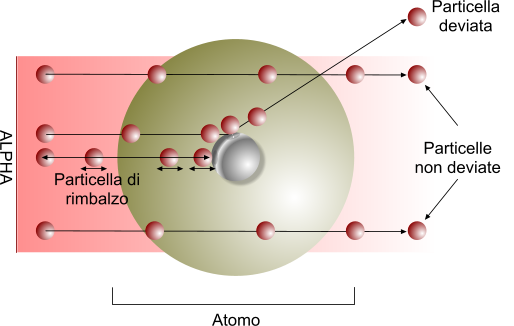
Attraverso un esperimento, Rutherford dimostrò che bombardando l'atomo con particelle alpha, soltanto una piccola parte di esse veniva deviata o rimbalzava, mentre la maggior parte passava attraverso, segno che il volume del nucleo atomico è molto piccolo e lascia passare le particelle alpha.
Il modello atomico di Bohr
Il moto planetario proposto da Rutherford, per quanto interessante potesse essere, si rivelò in palese contraddizione con le leggi fisiche che regolano e definiscono la quantità di energia. L'elettrone, ruotando attorno al nucleo, doveva prima o poi collassare su esso poiché, il movimento stesso, necessariamente determinava un trasferimento di energia, ad esempio mediante l'emissione di radiazioni. Il modello atomico di Bohr, in accordo con la neonascente meccanica quantistica, prevedeva che l'energia associata agli elettroni fosse quantizzata, in altre parole disponeva che gli elettroni avessero uno strato di energia quantizzato. In questo modo, il moto planetario degli elettroni poteva essere libero e infinito.
In realtà, secondo la teoria atomica di Bohr, gli elettroni si muovono lungo un orbitale elettronico e non sono vincolati a una specifica orbita che, invece, era prevista già a partire dal modello atomico di Thomson. Lo spazio intorno al nucleo è, in altre parole, più o meno popolato dagli elettroni che "idealmente" cessano di ruotare attorno all'atomo ma si dispongono lulgo lo spazio tridimensionale previsto dalla struttura atomica.
Struttura atomica
L'atomo è, convenzionalmente, suddiviso in due zone: il nucleo e il guscio esterno. Il nucleo è formato dalle particelle subatomiche, mentre il guscio esterno è formato dagli elettroni. Gli elettroni ruotano attorno al nucleo, in delle zone definite orbitali atomici.
Particelle subatomiche
Le particelle subatomiche rappresentano le entità che, aggregate tra loro, forniscono l'identità dell'atomo (dunque l'appartenenza a un determinato elemento della tavola periodica) e anche le proprietà fisico-chimiche associate all'atomo stesso.
Particelle subatomiche
| Particella |
Carica |
Descrizione |
|---|
| Protone |
Positiva |
Il protone è una particella subatomica, che fa parte del guscio. La sua carica positiva è stabilizzata dalla carica negativa dell'elettrone. Nell'atomo di idrogeno, più precisamente nell'isotopo prozio rappresenta esclusivamente il nucleo. |
| Neutrone |
Neutra |
Il neutrone è una particella subatomica, che fa parte del nucleo |
| Elettrone |
Negativa |
L'elettrone è una particella carica negativamente, è esterna al nucleo, stabilizzato dalla carica positiva del protone. |
Caratteristiche dell'atomo
L'atomo possiede differenti caratteristiche. I protoni e i neutroni, che fanno parte del nucleo, rappresentano la principale massa atomica. Il numero di protoni è, normalmente, equivalente al numero di elettroni. Quando uno elettrone viene sottratto oppure viene aggiunto, l'atomo passa dallo stato normale a quello ionico diventando uno ione. Qualora vi fosse un eccesso di elettroni l'atomo ha caratteristica anione qualora vi fosse un deficit di elettroni l'atomo è un catione.
Dimensione dell'atomo
La dimensione dell'atomo dipende, in larga misura, dal nucleo e dai protoni e neutroni in esso presenti. Gli atomi non possiedono limiti ben definiti ed osservabili, per questo motivo si cerca di riferirsi alla misura dell'atomo utilizzando alcuni parametri. L'unità di misura è il pM (picoMetro). L'atomo di elio, il più piccolo elemento, misura circa 49pM.
Dimensioni dell'atomo
| Tipo di misurazione |
Descrizione |
|---|
| Raggio atomico |
Dimensione dell'atomo, da intendersi in termini di raggio. Il limite teorico è quello del guscio esterno di elettroni. |
| Raggio ionico |
Simile al raggio atomico, ma si considera l'atomo soltanto quando è in forma di ione. |
| Raggio covalente |
Si considera la distanza dei due nuclei impegnati in un legame covalente. |
A una prima analisi, sembrerebbe plausibile che un maggior numero di protoni determini un maggiore raggio atomico, tuttavia la relazione è inversamente proporzionale. I protoni, carichi positivamente, attraggono gli elettroni e per questa ragione, il raggio atomico negli elementi con molti protoni diminuisce rispetto a quanto osservato negli elementi con pochi protoni.
Numero di protoni ed elettroni
In un atomo non ionizzato, affinché si possa definire neutro, il numero di protoni è sempre uguale al numero di elettroni. In questo modo, la carica netta dell'atomo è bilanciata dalla carica positiva dei protoni rispetto alla carica negativa degli elettroni.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?