Il modello dei ponti trasversali illustra il meccanismo di contrazione del sarcomero, mediante una sequenza ciclica di eventi che coinvolgono le proteine che fanno parte del sarcomero, come l'actina e la miosina.
La capacità contrattile del muscolo deriva dalla somma delle contrazioni dei sarcomeri che lo compongono. Qualsiasi tessuto muscolare è capace esclusivamente di contrarsi, mediante l’accorciamento dei sarcomeri, e distendersi a seguito di questo evento. Osservando al microscopio un sarcomero in fase di contrazione è possibile notare che le linee Z tendono ad avvicinarsi mentre la zona H si restringe. I filamenti sottili, formati da actina intrecciata, scorrono lungo i filamenti spessi di miosina che, idealmente, potrebbero essere identificati come delle guide di scorrimento.
Fasi del modello dei ponti trasversali
Ipoteticamente è possibile suddividere il ciclo dei ponti trasversali in 5 fasi:
- Aggancio della miosina all’actina. La testa della miosina, che possiede un residuo di ADP e un fosfato inorganico, ambedue derivanti da una precedente idrolisi, si trova nel cosiddetto stato ad alta energia. Quando la miosina è in questo stato è facilitata, grazie all’azione dello ione calcio, a legarsi all’actina mediante lo spostamento della testa.
- Colpo di forza. La miosina espelle l’ADP e il fosfato inorganico e, contemporaneamente, cambia la propria conformazione in modo tale da avvicinarsi alla zona H, ovvero il centro del sarcomero. Visto che miosina e actina sono ancora saldamente legate tra loro il movimento verso il centro della prima tira con se la seconda. Il movimento vero e proprio, infatti, è operato dalla miosina che trascina con sé l’actina.
- Rigor. La miosina, dopo l’espulsione del fosfato, si trova nello stato di rigor nel quale permane saldamente legata all’actina.
- Distacco della miosina dall’actina. Quando una molecola di ATP si aggancia alla testa della miosina avviene un ulteriore cambio conformazionale. In questo momento actina e miosina si distaccano.
- Attivazione della miosina. Subito dopo il legame ATP-miosina si ha l’idrolisi del primo in ADP e fosfato inorganico. L’evento di idrolisi di ATP (o GDP, in alcuni casi) è molto frequente a livello del metabolismo o, più in dettaglio, dell’enzimologia cellulare. In una reazione generica d’idrolisi del nucleotide trifosfato, tuttavia, l’ADP ed il fosfato inorganico vengono espulsi quasi immediatamente dai siti catalizzatori. Nell’attivazione della miosina, invece, questi due prodotti permangono nella testa della miosina e, pertanto, il ciclo può essere nuovamente compiuto.
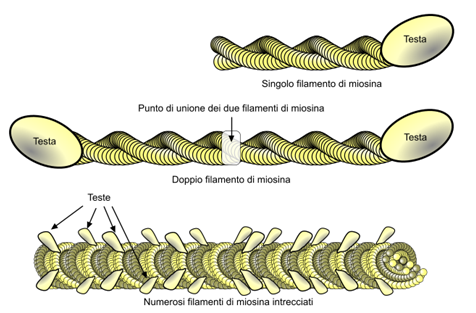
Filamenti di miosina
Scarica adesso l'ebook
110 domande di Fisiologia e mettiti alla prova con le domande di autovalutazione. Le domande proposte simulano un quiz universitario di verifica o un quiz di ammissione per le facoltà di Medicina, Biologia e qualsiasi altro percorso di Laurea a carattere scientifico.
Trasporti di membrana: Canale, gap junctions, trasporto passivo, trasporto attivo (Proteina CFTR), forza chimica, forza elettrica, forza elettrochimica, osmosi. regolazione del volume cellulare, pompa sodio-potassio, trasporto del glucosio.
Sistema nervoso:
Potenziale di membrana,
potenziale graduato,
potenziale di membrana a riposo,
potenziale d'azione.
Neurotrasmettitore,
arco riflesso,
arco riflesso polisinaptico,
evoluzione del sistema nervoso.
Sistemi sensoriali e
recettori sensoriali,
trasduzione del segnale,
vie sensoriali,
olfatto,
riflesso miotatico,
unità motoria,
circuito riverberante,
circuito aperto (
facilitazione e
occlusione),
scarica postuma,
sistema nervoso autonomo.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?