La pressione osmotica è, relativamente a due soluzioni di differente concentrazione, comunicanti tra loro mediante una membrana semipermeabile, la pressione necessaria a impedire il passaggio di acqua dalla zona a minore concentrazione alla zona a maggiore concentrazione. In base al principio che regola l'osmosi, l’acqua, se separata in due co mpartimenti da una membrana semipermeabile, tende a spostarsi da una zona a maggior potenziale (minore concentrazione di soluti), verso una zona a minor potenziale (maggiore concentrazione di soluti). Questo fenomeno avviene fino a quando non si raggiunge un medesimo potenziale.
Lo spostamento d’acqua derivante dall’osmosi può essere controbilanciato applicando una pressione nel compartimento con un minore potenziale idrico. Da quest’asserzione è possibile stabilire che la pressione osmotica deriva dalla concentrazione dei soluti e, dall’osmolarità.
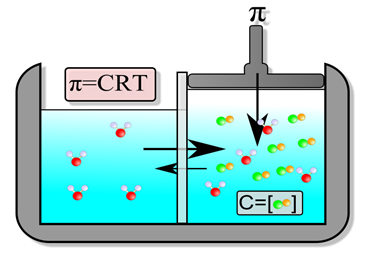
Pressione osmotica
Esiste una correlazione tra la legge dei gas perfetti (pV=nRT) e il calcolo della pressione osmotica che, matematicamente, è definibile in:
π = CRT
Formula di calcolo della pressione osmotica
Dove:
- π, rappresenta la pressione osmotica
- C, la concentrazione dei soluti, da intendere anche come ioni (osmolarità)
- R, la costante universale dei gas pari a 0.082
- T, la temperatura in gradi Kelvin
Scarica adesso l'ebook
110 domande di Fisiologia e mettiti alla prova con le domande di autovalutazione. Le domande proposte simulano un quiz universitario di verifica o un quiz di ammissione per le facoltà di Medicina, Biologia e qualsiasi altro percorso di Laurea a carattere scientifico.
Trasporti di membrana: Canale, gap junctions, trasporto passivo, trasporto attivo (Proteina CFTR), forza chimica, forza elettrica, forza elettrochimica, osmosi. regolazione del volume cellulare, pompa sodio-potassio, trasporto del glucosio.
Sistema nervoso:
Potenziale di membrana,
potenziale graduato,
potenziale di membrana a riposo,
potenziale d'azione.
Neurotrasmettitore,
arco riflesso,
arco riflesso polisinaptico,
evoluzione del sistema nervoso.
Sistemi sensoriali e
recettori sensoriali,
trasduzione del segnale,
vie sensoriali,
olfatto,
riflesso miotatico,
unità motoria,
circuito riverberante,
circuito aperto (
facilitazione e
occlusione),
scarica postuma,
sistema nervoso autonomo.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?