Uno ione è una definizione di un atomo o di una molecola che presenta una carica elettrica non neutra, ad esempo positiva o negativa. Affinché una entità chimica si definisca ione è necessario che il numero totale dei protoni, che rappresentano le particelle del nucleo con carica positiva, e il numero totali degli elettroni, presenti all'esterno del nucleo nel cosiddetto guscio elettronico, non siano uguali.
La presenza di un numero maggiore di protoni rende la molecola uno ione positivo o catione. Viceversa, la presenza di un numero maggiore di ioni negativi rende la molecola un anione o ione positivo. Quando il numero di protoni eguaglia quello degli elettroni, la molecola si definisce elettricamente neutra.
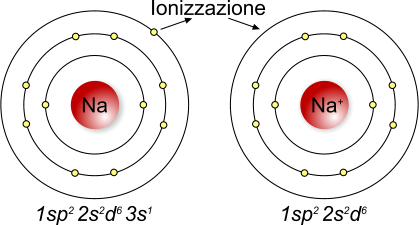
Il sodio è un
elemento che, se privato di un elettrone, diventa sodio cationico
In base al numero di atomi, si classificano ioni monoatomici e ioni poliatomici, altrimenti definite come molecole ioniche.
Ioni monoatomici
Uno ione monoatomico è un atomo che ha ceduto oppure acquistato uno o più elettroni. Ad esempio, il sodio (Na), il calcio (Ca) e l'alluminio (Al) sono elementi capaci di cedere un elettrone e diventare, rispettivamente, cationi monovalenti, bivalenti e trivalenti.
Lo zolfo (S), e l'azoto (N), invece sono molecole che, normalmente, acquistano elettroni per diventare, rispettivamente, anioni bivalenti e trivalenti.
Ioni poliatomici
Uno ione poliatomico o, generalmente, molecola ionica è un insieme di atomi che possiedono una carica netta positiva o negativa. Lo ione ammonio (NH4+) e lo ione cianuro (CN-) sono, rispettivamente, esempi cationi poliatomici e anioni poliatomici.
Proprietà chimiche degli ioni
Gli ioni possiedono alcune proprietà chimiche e fisiche che determinano il comportamento e l'interazione con altri ioni o molecole.
Energia di ionizzazione
L'energia di ionizzazione, o energia di ionizzazione primaria, è la quantità di energia, espressa in kJoule/mol necessaria per allontanare l'elettrone più esterno da una mole di atomi allo stato di gas, appartenenti allo stesso elemento, trasformando di fatto gli atomi in cationi monovalenti. Ad esempio, l'energia di ionizzazione del sodio è pari a 494kJ/mol e indica che servono 494kJ per rendere una mole di atomi di sodio (Na), presenti in forma gassosa, cationi monovalenti (Na+). L'energia richiesta per formare dei cationi bivalenti è definita energia di seconda ionizzazione, ed assume valori progressivamente superiori poiché è maggiore l'energia necessaria per vincere l'attrazione del nucleo atomico verso l'elettrone.
Attrazione elettrostatica
Ioni di carica diversa, ad esempio anioni e cationi, tendono ad attrarsi e, qualora vi fossero le condizioni, formare un legame ionico che, pur non generando una vera e propria molecola, tende a stabilizzare il sistema ionico. Il cloruro di sodio, ad esempio, è un sale che è formato da ioni cloruro e ioni sodio impacchettati in un reticolo cristallino.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?