Il legame ionico è un tipo di legame inter-atomico che permette di stabilire un legame chimico tra due atomi con differente elettronegatività; affinché possa formarsi un legame ionico è necessario che un atomo possieda una bassa energia di ionizzazione e l'altro possieda un'alta affinità elettronica. Sebbene non ci sia un vero e proprio parametro standardizzato, il legame si definisce ionico quando la differenza di elettronegatività ( ) tra gli atomi supera il valore di 1.9. Valori inferiori, relativi alla differenza di elettronegatività, in genere, indicano la presenza di un legame covalente.
Il legame ionico è un tipo di legame debole. La maggior parte delle molecole legate attraverso un legame ionico o, comunque, una interazione di natura elettrostatica si dissociano se poste il soluzione acquosa.
Definizione di legame ionico
La definizione di legame ionico è molto semplice: si definisce ionico o elettrostatico un tipo di legame nel quale gli atomi che partecipano alla formazione della
molecola possiedono una marcata differenza di elettronegatività.
Nel legame ionico, un atomo dona uno o più elettroni a un atomo accettore formando, rispettivamente, un catione o ione positivo e un anione o ione negativo. Per questa ragione, il legame ionico ha un forte carattere elettrostatico. In linea generale, gli atomi che sono stabili grazie a un legame ionico non sono propriamente definibili come molecole poiché tra loro non vi è una compartecipazione di elettroni in un orbitale molecolare, bensì un'attrazione di natura elettrostatica. Nella concezione comune, il legame elettrostatico è un sinonimo di legame ionico anche se,
Convenzionalmente, riportare gli atomi coinvolti in un legame ionico ha il puro scopo di illustrare il rapporto tra gli atomi nella struttura che si forma. Ad esempio, la formula minima NaCl indica che per ogni molecola di sodio (Na) vi è una molecola di cloro (Cl). Allo stesso modo, nel fluoruro di calcio, la formula CaF2, indica che il rapporto tra il fluoro (F) e il calcio (Ca) è pari a 2:1.
Esempio di legame ionico: cloruro di sodio
Il cloruro di sodio, o sale da cucina, è un sale ottenuto dalla reazione tra acido cloridrico e idrossido di sodio. La molecola rappresenta un esempio di sostanza nella quale gli atomi sono legati tra loro attraverso un legame ionico.
Il sodio (Na) si lega al cloro (Cl) attraverso un'interazione elettrostatica poiché il cloro, per raggiungere l'ottetto acquisisce l'elettrone di valenza del sodio. Il cloro diventa una specie anionica, poiché ha una carica negativa derivante dall'elettrone in eccesso, mentre il sodio diventa una specie cationica, carica positivamente, poiché è privata di un elettrone.
Il sodio possiede un solo elettrone di valenza poiché la sua configurazione elettronica è 1s2 2s2 2p6 3s1, cedendo l'elettrone raggiunge la configurazione del gas nobile che lo precede, il neon. Il cloro, invece. ha configurazione elettronica 1s2 2s2 2p6 3s2 3p5, e raggiunge la configurazione stabile dell'ottetto (3s2 3p6) subito dopo l'acquisto dell'elettrone del sodio.
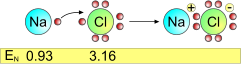
Il cloro, maggiormente elettronegativo, attira a sé l'elettrone di valenza del sodio. Si formano, rispettivamente, un anione e un catione tenuti tra loro da una forza di legame elettrostatica.
Formazione dei cristalli
L'aggregazione di più atomi attraverso il legame ionico porta alla formazione di strutture regolari, dalla disposizione ripetuta e continua nello spazio: i cristalli. Allo stato solido i sali, infatti, sono presenti in una disposizione spaziale che è definita a reticolo cristallino, altamente ottimizzata affinché l'energia reticolare (l'energia totale del sistema cristallino) sia minima.
La disposizione tridimensionale degli atomi segue la cosiddetta geometria di legame che, a sua volta, è teorizzata dalla teoria del massimo impacchetamento, secondo la quale gli ioni si dispongono in modo tale da minimizzare la rispettiva distanza anione-catione.
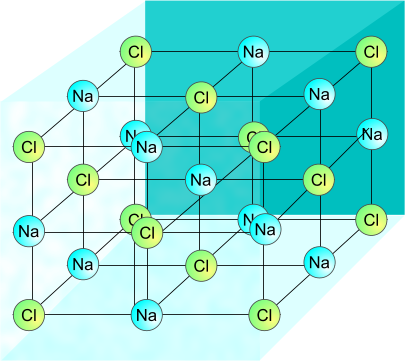
Reticolo cristallino formato dal cloruro di sodio.
La presenza di un reticolo cristallino rende il legame ionico non direzionale, a differenza dei legami covalenti che sono, invece, direzionali. Inoltre, il numero di legami che possono formarsi differisce in numero di coordinazione cationico, se riguarda il catione, o numero di coordinazione anionico se riguarda l'anione.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?