L'
acido cloridrico o
cloruro di idrogeno o
acido muriatico è un
acido minerale molto forte, che in
acqua si dissocia totalmente in idrogeno (H
+) e cloro (Cl
-). L'
acido cloridrico è una acido monoprotico; per questa ragione, in
soluzione acquosa, per ogni
equivalente di acido cloridrico, a seguito della dissociazione, è prodotto un equivalente protonico.
Dal punto di vista biologico, l'acido cloridrico, è secreto dalle cellule ossintiche o cellule parietali, presenti a livello della mucosa gastrica dello stomaco.
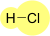
Formula di struttura e tipo di legame nell'acido cloridrico.
Formula
La formula dell'acido cloridrico è HCl. La rappresentazione grafica lascia, velocemente, intendere la presenza di un atomo d'idrogeno legato, attraverso un legame covalente a uno di cloro.
Caratteristiche chimiche
L'acido cloridrico è un acido molto forte; a titolo di esempio una mole di acido cloridrico disciolta in un litro di acqua (soluzione 1 molare) porta il pH della soluzione a 0. Per questo motivo è un acido molto corrosivo, capace di deteriorare numerose altre molecole, di natura sintetica, organica e biologica.
Biosintesi
A livello della mucosa gastrica, è sintetizzato nello stomaco dalla cellule ossintiche, in risposta a un complesso sistema di segnalazione ormonale, ad esempio mediato dalla gastrina e dall'istamina H2. Il tipo di movimento è mediato dal trasporto attivo e richiede ATP. In un contesto patologico, l'eccessiva secrezione di acido cloridrico, comporta la cosiddetta condizione di acidità di stomaco che viene curata sia con principi attivi che bloccano la pompa protonica, chiamati inibitori della pompa protonica, sia con antiacidi generici, o con molecole più selettive che bloccano i recettori per l'istamina, chiamati H2 antagonisti.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?